
 鳥インフルエンザA(H5N1)ウイルス
鳥インフルエンザA(H5N1)ウイルス
東京大学医科学研究所 感染・免疫部門 ウイルス感染分野
渡辺 登喜子
河岡 義裕
Ⅰ. はじめに
毎年冬に流行するインフルエンザは、高齢者や乳幼児で重症化しやすく、社会的に大きな問題となっています。また、ブタ由来のインフルエンザウイルス(A/H1N1pdm)が2009年に出現したように、インフルエンザウイルスは数十年に一度、世界的大流行(パンデミック)を引き起こし、世界中で甚大な被害をもたらします。さらに、A/H5N1亜型やA/H7N9亜型といった鳥インフルエンザウイルス(以下、「鳥ウイルス」という)がヒトに感染して重篤な症状を起こす例が多く報告されており、鳥ウイルスによるパンデミックの危険性も懸念されています。今回の「過去のパンデミックレビュー」では、鳥インフルエンザA(H5N1)について概説します。
Ⅱ. A型インフルエンザウイルスとは
インフルエンザウイルスにはA、B、C、Dの4つの型があり、このうちA型とB型がヒトの世界において、流行的な広がりを見せます。上述のパンデミックを起こすウイルスやH5N1亜型・H7N9亜型などの鳥ウイルスは、A型インフルエンザウイルスに分類されています。A型インフルエンザウイルスは、非常に広い宿主域(感染可能な動物種の範囲)を持っており、ヒトやニワトリなどの家きん(ニワトリ、アヒル、ウズラなど鳥類の家畜)だけでなく、ウマ、ブタ、イヌ、アザラシ、クジラなどにも感染する人獣共通感染症です(図1) 1)。
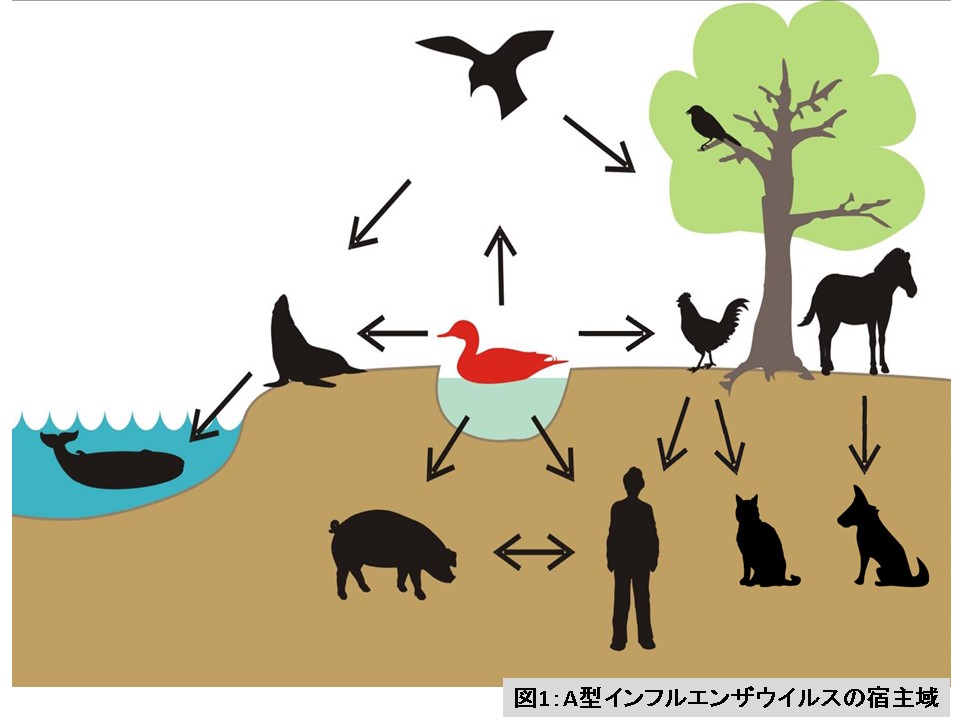
(図1の説明)
A型インフルエンザウイルスは自然界に広く分布しており、様々な種類の動物から分離される。
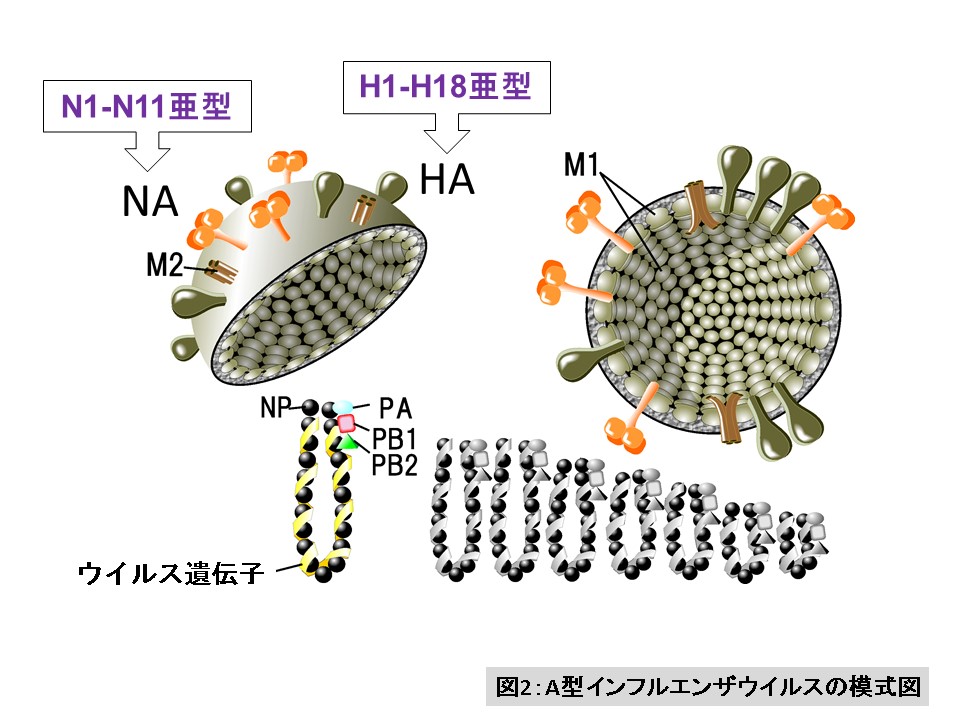
A型インフルエンザウイルスの表面にはHA(ヘマグルチニン)とNA(ノイラミニダーゼ)という2種類の糖蛋白質が存在しており、現時点では、抗原性の違いから、18種類のHAと11種類のNAの亜型に分類されています(図2) 1-3)。インフルエンザウイルスの自然宿主(自然界で寄生体と共生している宿主のことで、通常寄生体は自然宿主に対して無害)であるカモなどの水鳥からは、ほとんど全てのHAとNA亜型のウイルスが分離されています 1)。ヒトなどの哺乳類では、インフルエンザウイルスは主に呼吸器官で増えます。それに対して水鳥は、インフルエンザウイルスに経口感染し、腸管内で増殖したウイルスを糞便とともに排泄します。水鳥が排泄したインフルエンザウイルスは、水を介して他の個体へと伝播します。このように自然宿主である渡り鳥は、様々な亜型のインフルエンザウイルスを保有しており、世界中にウイルスを運びます。そのため、カモなどの渡り鳥は“インフルエンザウイルスの運び屋”と称されることがあります。
(図2の説明)
A型インフルエンザウイルスの表面にはHAとNAという表面糖蛋白質がある。抗原性の違いから、18種類のHAと11種類のNAの亜型に分類されている。ウイルス粒子内では、8本のウイルス遺伝子がポリメラーゼ蛋白質(PB2,
PB1およびPA)とNPと結合して、複合体を形成している。
Ⅲ. パンデミックインフルエンザウイルスの出現メカニズム
1ヒトにおけるパンデミックウイルスの出現と流行の変遷
パンデミックの原因となるのはA型インフルエンザウイルスです。20~21世紀に、人類は4回のインフルエンザパンデミックを経験しました。その中でも1918年に起こったスペイン・インフルエンザウイルスによるパンデミックの被害がもっとも甚だしく、世界人口の約30%が感染し、死亡者数が推定4000万人以上という、疫学史上最悪の事態となりました。図3に示すように、1918年にスペイン・インフルエンザを引き起こしたA/H1N1ウイルスは、1957年にアジア・インフルエンザを引き起こしたA/H2N2ウイルスに取って代わられるまで、季節性インフルエンザウイルスとして39年間ヒトの間で流行を繰り返しました。アジア・インフルエンザの発生から11年後の1968年には、A/H3N2ウイルスに起因する香港・インフルエンザが流行し、A/H2N2ウイルスは姿を消しました。このA/H3N2ウイルスは、現在まで季節性インフルエンザウイルスとして毎冬の流行を繰り返しています。1977年にはスペイン・インフルエンザ由来のA/H1N1ウイルスが再び登場し、ソ連・インフルエンザの流行を引き起こしました。ソ連・インフルエンザウイルスは、その後、季節性インフルエンザウイルスとして存続しましたが、ブタ由来インフルエンザウイルス(A/H1N1pdm)の出現によって姿を消しました。パンデミックの後、A/H1N1pdmは季節性インフルエンザウイルスとして存続しています。
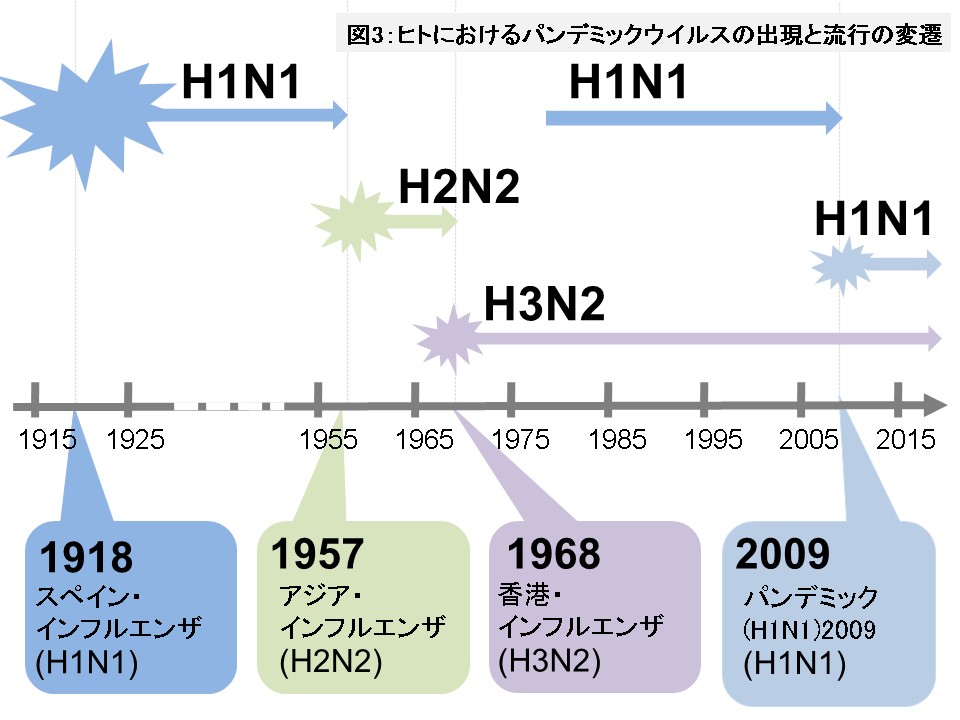
(図3の説明)
20~21世紀に人類は4度のインフルエンザパンデミックを経験した。1918年のスペイン・インフルエンザでは2000万~4000万人、1957年のアジア・インフルエンザでは200万人、1968年の香港・インフルエンザでは100万人もの犠牲者が出た。スペイン・インフルエンザのA/H1N1ウイルスはアジア・インフルエンザA/H2N2ウイルスが現れた時に、またA/H2N2ウイルスは香港・インフルエンザA/H3N2ウイルスが現れた時に、それぞれ姿を消した。1977年にはスペイン・インフルエンザ由来のA/H1N1ウイルスが再び登場し、ソ連・インフルエンザとして流行していたが、2009年にパンデミックを引き起こしたブタ由来インフルエンザウイルス(A/H1N1pdm)の出現によって姿を消した。現在、A型ではA/H1N1pdmと香港・インフルエンザA/H3N2の2種類が季節性ウイルスとして流行している。
2A型インフルエンザウイルスの変異
A型インフルエンザウイルスでは、機序の異なる2種類の抗原変異が起こります 1)。一つは、日常的に起こる変異で、毎年の流行を引き起こしています(これを「連続変異」といいます)。もう一つは、それまでヒトの間で流行していたウイルスとは異なる型のウイルスが突然出現する現象のことです(これを「不連続変異」といいます)。ヒトはそのように突然出現した型のウイルスに対する免疫を持っていないため、パンデミックが起こります。このようなウイルスは人類にとっては“未知”のウイルスに等しく、したがって、ひとたびパンデミックが発生すれば、世界中で甚大な被害をもたらします。またHAとNAの亜型は同じでも、それまでに流行したウイルスと抗原性が著しく異なるウイルスが出現した場合にも、パンデミックが起こることがあります。その一例が、2009年に今世紀最初のパンデミックを引き起こしたブタ由来インフルエンザウイルス(A/H1N1pdm)です。
3パンデミックウイルス出現におけるブタの役割
上述の通り、カモなどの渡り鳥は、様々な亜型のインフルエンザウイルス、すなわち『パンデミックウイルスの素』の運び屋であると考えられています。しかし、通常、鳥ウイルスが直接ヒトに感染して流行を起こすことはなく、また、ヒトインフルエンザウイルス(以下、「ヒトウイルス」という)が鳥に感染することもありません。そこで、鳥ウイルスとヒトウイルスの双方が感染する媒体として、第3の動物、ブタの存在が提唱されています 4-6)。ブタの呼吸器上皮細胞には、ヒトウイルスに対するレセプターだけでなく、鳥ウイルスに対するレセプターもあるため、双方のウイルスがブタに感染することができます。鳥ウイルスとヒトウイルスという2種類の異なるA型インフルエンザウイルスが、同時にブタに感染すると、それぞれ8本ずつのウイルス遺伝子分節がブタの中で混ざり合い(これを“遺伝子再集合”といいます)、その結果、鳥ウイルスとヒトウイルスの遺伝子再集合体(リアソータント)が出来上がります。もし、このリアソータントウイルスが、これまでヒトが経験したことのない亜型のHAやNAを有しており、かつ、ヒト集団で流行を引き起こす能力を持っていれば、ヒト社会でインフルエンザパンデミックを引き起こすこととなります。
1968年に香港・インフルエンザを引き起こしたパンデミックウイルス(A/H3N2)は、遺伝子再集合体であることがわかっていますが 7-8)、遺伝子再集合がブタで起きたかどうかは証明されていません。
Ⅳ. 鳥インフルエンザウイルスのヒトへの感染
11997年の香港での感染事例と2003年以降の状況
ところが、1997年香港において、当時、生きた鳥を売買している市場で流行していた高病原性の鳥インフルエンザA(H5N1)ウイルス(以下、「H5N1鳥ウイルス」という)が、直接ヒトに伝播し、18人が感染、そのうち6人が死亡しました 9)。今までヒトが経験したことがない亜型のH5N1鳥ウイルスが、鳥からヒトへ直接伝播したという事実は、世界に衝撃を与えました。幸い、このウイルスがヒトからヒトへと伝播することはなかったため、パンデミックに至ることはなく、香港政府が生鳥市場の全ての鳥を殺処分したため、それ以上の被害をくいとめることができました。このとき市場のニワトリとヒトから分離されたH5N1鳥ウイルスは、広範囲な疫学調査から、もともとは渡り鳥のウイルスに由来することが判明しています。
また1999年には、香港および中国本土において、鳥インフルエンザA(H9N2)ウイルス(以下、「H9N2鳥ウイルス」という)がヒトから分離されました 10)。このH9N2鳥ウイルスは、H5N1鳥ウイルスよりも病原性が低く、ヒトでの流行も起こしませんでしたが、分離したウイルスの遺伝子解析の結果、ウイルスの内部蛋白質をコードする遺伝子分節が、1997年のH5N1鳥ウイルスのものと近縁であることが分かりました 11)。H9N2鳥ウイルスは、1997年当時すでに、H5N1鳥ウイルスとともに、香港の家きんから分離されており、これらのウイルス間で、遺伝子再集合が起こったものと推察されています。さらに2001年にも、同じく香港市場の鳥から、他の亜型のウイルスとのリアソータントである高病原性H5N1鳥ウイルスが分離されました 12)。この時も、事態を重く見た香港政府が、いちはやく、市場の鳥を全て殺処分したため、1997年のようなヒトへの感染は見られませんでしたが、このH5N1鳥ウイルスがヒトに感染する可能性は確かに存在していました。
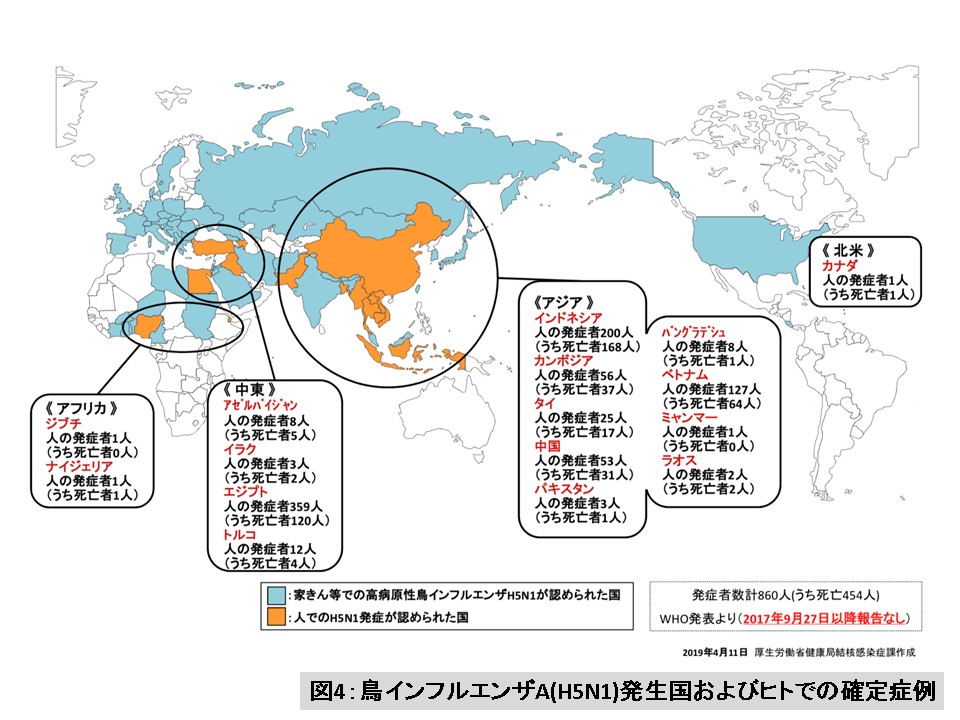
一旦終息したかのように見えた高病原性H5N1鳥ウイルス感染騒動が再燃したのは、東アジア諸国で、H5N1鳥ウイルスの流行が起こりはじめた2003年末のことです。このH5N1鳥ウイルスの流行は、家きんだけでなく渡り鳥のような野鳥にまで波及したため、アジア諸国だけに留まらず、ヨーロッパやアフリカまで拡大していき、それに伴い、ヒトにおける感染例の報告も増えていきました。世界保健機関(WHO)の報告によると、現在までに、世界十数カ国でH5N1鳥ウイルスのヒトにおける感染が確認されており、感染者数は860人で、そのうち、454人が亡くなっています(2019年4月9日現在)(図4) 13)。
(図4の説明)
2003年11月から2017年9月27日までの、H5N1鳥インフルエンザの発生国およびヒトでのH5N1鳥ウイルス感染例について、世界保健機関(WHO)および国際獣疫事務局(OIE)から公表されたデータに基づく。(厚生労働省のウェブサイトに掲載されていた図(2019年4月11日厚生労働省健康局結核感染症課作成)を転載)
2鳥インフルエンザA(H5N1)ウイルスの疫学と臨床症状
H5N1鳥ウイルスのヒトへの感染は、市場で生きたままの家きんが売られているような、ヒトと家きんの距離が非常に近い地域で多く起こっています。感染者の多くが、鳥インフルエンザに罹患した鳥との接触歴があることから、感染した鳥からヒトに直接伝播したと考えられています。現在までのところ、ヒト-ヒト間でH5N1鳥ウイルスが効率よく伝播する例は報告されていません。
H5N1鳥ウイルスに感染すると、普通の季節性インフルエンザと同様に、38度以上の発熱および呼吸器症状に加えて、頭痛、筋肉痛などの症状を示します。また腹痛、胸痛、下痢などの症状を示すこともあります。喉の痛みや鼻症状など、上気道における症状はあまり認められません。重症例では、経過の早い進行性の肺炎を併発して、急性呼吸窮迫症候群(Acute Respiratory Distress Syndrome: ARDS)や、腎機能障害、肝機能障害、心不全などの多臓器不全などを引き起こして、死亡する場合が多いことが報告されています。治療としては、ノイラミニダーゼ阻害薬(オセルタミビル、ザナミビル)などの抗ウイルス薬投与が行われており、一定の効果をあげています。しかしながらオセルタミビルに対する耐性株の出現が報告されているため、投与後のモニタリングが重要です。
Ⅴ. 鳥インフルエンザA(H5N1)パンデミックの可能性
1H5N1鳥ウイルスとレセプター特異性
鳥インフルエンザウイルスが、他の動物へと伝播することはまれです。なぜなら、そこにはウイルスの“レセプター特異性”という宿主特異性を決めるバリアーがあるからです。インフルエンザウイルスの感染は、ウイルスのHAが宿主細胞表面に存在するレセプターに結合することからはじまります。ヒトと鳥のウイルスは異なるレセプターを認識します(便宜上、以下「ヒト型レセプター」及び「鳥型レセプター」という。)。すなわち、鳥ウイルスが増殖する水鳥の腸管上皮細胞の細胞表面には鳥型レセプターが、ヒトウイルスが効率良く増殖するヒトの上気道(鼻腔や喉)の上皮細胞表面にはヒト型レセプターが多く存在しますが、それぞれもう一方のレセプターはほとんど存在しません。そのため、鳥ウイルスは容易にはヒトの上気道で増えることができません。
それではH5N1鳥ウイルスはどうやってヒトに感染したのでしょうか?その謎を解く鍵は、ヒト体内におけるレセプター分布にありました。H5N1鳥ウイルスに感染した患者では、季節性インフルエンザの場合と違い、ウイルス性肺炎を頻発することや、上気道よりも気道の深部からの方がウイルスの分離率が高いことが臨床的に知られていました。そこで、細気管支や肺といったより深部の呼吸器を含めて、ヒトの呼吸器におけるレセプター分布状況を詳細に調べたところ、ヒトの呼吸器深部では、ヒト型レセプターだけでなく、鳥型レセプターも分布していることが分かりました 14-15)。このヒト呼吸器におけるレセプター分布の様子は、H5N1鳥ウイルス感染による病態、すなわち重度の下気道疾患をよく説明しています。鳥との濃厚接触など、何らかの原因により、一度に多量のウイルスが鳥型レセプターを発現している呼吸器深部(肺)まで入り込むと、H5N1鳥ウイルスの感染が成立し、肺炎を起こすと考えられます。
2鳥インフルエンザA(H5N1)ウイルスはヒト-ヒト間で伝播できるようになるのか?
インフルエンザウイルス遺伝子には高頻度で変異が入ることから、環境に適した変異ウイルスが出現しやすいと考えられています。そのため、ヒト型レセプターを認識するHAを持つ変異H5N1鳥ウイルスが出現すれば、変異H5N1鳥ウイルスはヒトで効率良く増殖し、さらにヒトからヒトへ伝播するようになる可能性が高くなります。それでは、H5N1鳥ウイルスがどのような変異を獲得すると、ヒト型レセプターを認識するようになるのでしょうか?
H5N1鳥ウイルスがヒト型レセプターを認識するのに重要なアミノ酸変異を調べるために、私たちは、2004年から2005年にかけてヒトから分離されたH5N1鳥ウイルスのレセプター特異性の解析を行いました。その結果、鳥から分離されたウイルス5株は、鳥型のレセプターのみを認識したのに対し、ヒトから分離されたウイルスは、数株が鳥型のレセプターだけでなくヒト型のレセプターも認識することが分かりました。さらに、それらのウイルスのHAの遺伝子解析の結果、ヒト型レセプター認識に関わるいくつかのアミノ酸変異が明らかになりました 16)。実際に、2006年にアゼルバイジャンやイラクにおいてヒトから分離されたH5N1鳥ウイルスでは、このようなアミノ酸変異が見つかっています。また、H5N1鳥ウイルスのヒトでの感染例の報告が多いエジプトにおいても、ヒト型レセプターを認識するアミノ酸変異を持つH5N1鳥ウイルスが分離されており、そのような変異H5N1鳥ウイルスがヒトの上気道の細胞で増殖しやすくなっていることも示されています 17)。
また私たちは、H5N1鳥ウイルスにおいて、ヒト-ヒト間の伝播を担う要因を明らかにするために、インフルエンザウイルス感染のモデル動物であるフェレットを用いた感染実験を行いました。まず、ヒト型レセプターを認識する変異H5HAを持つウイルスを作出し、フェレットに感染させました。この変異ウイルスが、感染フェレットの体内で増殖する際に、HAにさらに変異が入り、その結果H5N1鳥ウイルスがフェレットの呼吸器でよく増えるようになりました。さらに、変異H5N1鳥ウイルスはフェレット間で伝播することが確認されました。フェレット間で伝播したウイルスのHAにはさらに変異が入っており、合計4個の変異が起こるとフェレット間のウイルス伝播効率が大幅に上昇することが明らかとなりました 18)。
これらの研究成果は、パンデミックウイルスの出現を監視する上で非常に重要な知見となります。
Ⅵ. おわりに
1997年香港において、高病原性H5N1鳥ウイルスの初めてのヒトへの感染例が報告されてから、20年以上が経過しました。2017年の感染事例の報告以来、H5N1鳥ウイルスのヒトへの感染はしばらく途絶えていましたが、2019年5月2日、WHOはネパールにおけるH5N1鳥ウイルスのヒトへの感染例を報告しています。2003年以降、H5N1鳥ウイルスの流行は、家きんだけでなく渡り鳥のような野鳥にも広がったため、世界中へと拡大しました。日本でも、2004年の山口県、大分県、京都府の家きんにおける高病原性H5N1鳥インフルエンザの発生に始まり、その後、2010年10月から2011年5月にかけて行われた死亡野鳥等の調査により高病原性H5N1鳥ウイルスが60件検出されましたが、2011年4月以降、日本では家きん及び野鳥のいずれからも高病原性H5N1鳥ウイルスは検出されていません(令和元年5月31日時点)。高病原性H5N1鳥インフルエンザに対するワクチン接種は、日本では行われていませんが、いくつかの国では家きんへのワクチン接種が行われました。しかし、家きんに対する鳥インフルエンザワクチンの接種は、ウイルス感染を完全に防御することができません。そのため家きんの世界で変異ウイルスが出現し、常在化するという問題をはらんでいます。したがって、ヒトでの感染報告がほとんどなく、また家きんでの被害がないからといって、H5N1鳥ウイルスを制御できていると事態を楽観視することはできません。またH5N1亜型以外にも、H5N6、H7N9、H9N2亜型の鳥ウイルスのヒトへの感染例も報告されており、日本における鳥インフルエンザウイルスのヒトへの感染報告がないにせよ、鳥インフルエンザウイルスの状況は依然として警戒体制下にあると言えるでしょう。最近の研究から、鳥インフルエンザウイルスのヒトーヒト間の伝播に関与する可能性のある変異が同定されています。世界規模のサーベイランスによって、このような変異を持つ鳥インフルエンザウイルスや、ヒトインフルエンザウイルスとのリアソータントの出現をモニタリングすることは公衆衛生上非常に重要であり、今後のインフルエンザ・パンデミック対策計画を策定・実施する上で、重要な情報となることでしょう。
【引用文献】
1) Wright PF, Neumann, G., and Kawaoka, Y., editor (2007) Orthomyxoviruses. Fields Virology, 5 th ed.
Philadelphia: Lippincott Williams & Wilkins. 1691-1740 p.
2) Tong S, Li Y, Rivailler P, Conrardy C, Castillo DA, et al. (2012) A distinct lineage of influenza A virus
from bats. Proc Natl Acad Sci U S A 109: 4269-4274.
3) Tong S, Zhu X, Li Y, Shi M, Zhang J, et al. (2013) New world bats harbor diverse influenza a viruses.
PLoS Pathog 9: e1003657.
4) Kida et al., Origin of the hemagglutinin gene of H3N2 influenza viruses from pigs in China. Virology,
162: 160-166, 1988
5) Kida et al., Potential for transmission of avian influenza viruses to pigs. J Gen Virol 75: 2183-2188,
1994
6) Ito T et al., Molecular basis for the generation in pigs of influenza A viruses with pandemic potential.
J Virol 72:7367-7373, 1998.
7) Yasuda J, Shortridge KF, Shimizu Y, Kida H. (1991) Molecular evidence for a role of domestic ducks in the
introduction of avian H3 influenza viruses to pigs in southern China, where the A/Hong Kong/68 (H3N2) strain
emerged. J Gen Virol. 72: 2007-2010.
8) Kida H, Ito T, Yasuda J, Shimizu Y, Itakura C et al. (1994) Potential for transmission of avian influenza
viruses to pigs. J Gen Virol. 75: 2183-2188.
9) Subbarao K, Klimov A, Katz J, Regnery H et al. (1998) Characterization of an avian influenza A (H5N1)
virus isolated from a child with a fatal respiratory illness. Science 279: 393-396.
10) Peiris M, Yuen KY, Leung CW, Chan KH, Ip PL et al. (1999) Human infection with H9N2. Lancet 354:
916-917.
11) Guan Y, Shortridge KF, Krauss S, Webster RG. (1999) Molecular characterization of H9N2 influenza
viruses: were they the donors of the “internal” genes of H5N1 viruses in Hong Kong? Proc Natl Acad Sci USA 96:
9363-9367.
12) Guan Y, Peiris JS, Lipatov AS, Ellis TM, Dyrting KC et al. (2002) Emergence of multiple genotypes of
H5N1 avian influenza viruses in Hong Kong SAR. Proc Natl Acad Sci USA 99: 8950-8955.
13) https://www.who.int/influenza/human_animal_interface/2019_04_09_tableH5N1.pdf
14) Shinya K, Ebina M, Yamada S, Ono M, Kasai N et al. (2006). Avian flu: influenza virus receptors in the
human airway. Nature 440, 435-436.
15) van Riel D, Munster VJ, de Wit E, Rimmelzwaan GF, Fouchier RA et al. (2006) H5N1 Virus Attachment to
Lower Respiratory Tract. Science 312, 399.
16) Yamada S, Suzuki Y, Suzuki T, Le MQ, Nidom CA et al. (2006) Haemagglutinin mutations responsible for the
binding of H5N1 influenza A viruses to human-type receptors. Nature 444, 378-382.
17) Watanabe Y, Ibrahim MS, Ellakany HF, Kawashita N, Mizuike R et al. (2011) Acquisition of human-type
receptor binding specificity by new H5N1 influenza virus sublineages during their emergence in birds in Egypt.
PLoS Pathog 7, e1002068.
18) Imai M, Watanabe T, Hatta M, Das SC, Ozawa M et al. (2012) Experimental adaptation of an influenza H5 HA
confers respiratory droplet transmission to a reassortant H5 HA/H1N1 virus in ferrets. Nature 486, 420-428.